细胞外囊泡(EVs)是细胞衍生出的膜结构囊泡,如外泌体、微囊泡和凋亡小体等。由于在囊泡腔内包裹着或在颗粒表面修饰着丰富的成分,EVs在治疗各类危及生命的疾病方面有巨大潜力。通常情况下,源于免疫细胞外泌体对肿瘤表现出不同的免疫治疗效果。另外,由于其天然独特的特性,EVs在药物递送方面表现出卓越的性能,包括但不限于固有稳定性、生物膜透性、低免疫原性和归巢能力。前人研究证明,装载阿霉素的外泌体对乳腺癌细胞有靶向细胞毒性作用,且与游离药物相比,心脏毒性和副作用更小。另外一个研究表明,装载紫杉醇的外泌体对多药耐药肺癌有良好的治疗效果。外泌体甚至能够通过血脑屏障递送药物,为神经系统疾病提供了可能的解决方案。除了有效的体内外实验结果外,将外泌体作为药物载体有着巨大的转化潜力。源于间充质干细胞的外泌体装载KRAS G12D siRNA后对胰腺癌的治疗效果正进行Ⅰ期研究。尽管前景广阔,但它们距离全面临床转化阶段还很远。一个最重要的原因就是大多数EVs由于其纳米直径被保留在网状内皮系统中,然后被单核巨噬细胞和其他细胞吸收。为了提高药物递送精度和减少副作用,在目标组织处通过EVs释放特定药物非常可取,但具有挑战性。
在过去的几十年里,光动力疗法(PDT)由于其突出的优势,已成为癌症治疗的新模式,比如时空可控性、最小侵入性、高效性和低毒性。该疗法已被证实对多种有效,且目前几种光敏剂已被美国食品和药物管理局批准用于治疗某些癌症。此外,该疗法与其他治疗方法结合,可进一步提高治疗效果(比如光热疗法、放射疗法、免疫疗法和基因疗法)。PDT与PDL-1检查点阻断免疫疗法的协同作用,不仅可以消除原发性肿瘤,而且可以触发系统性的肿瘤特异性细胞毒性T细胞反应,从而完全抑制未治疗的转移瘤。即便如此,PDT对深部肿瘤的治疗效果受到激发光透性差、效率低的严重影响。作为一个有吸引力的替代方案,光敏剂通过原位化学反应产生化学能的激发不受透性的限制。Yu等通过构建基于化学发光共振能量转移的仿生纳米反应器,制定的光动力-饥饿协同治疗策略对深部转移瘤表现出良好的治疗效果。然而,由于化学能通常是H2O2与过氧草酸酯衍生物反应产生的,此类化学激发PDT严重依赖于过氧化氢。尽管与正常组织相比,肿瘤微环境中的H2O2水平升高,但持续的反应会迅速耗尽肿瘤组织局部的H2O2供应,PDT的治疗效果将明显受限。为了提高化学激发的PDT效率,需要在肿瘤微环境中充分补充H2O2。然而,H2O2增强剂的可靠性以及增强剂与光敏剂(PSs)共同递送到肿瘤的有效策略仍然十分有限。
该研究构建了自激活自发光的EVs递送系统,同时展示三种协同抗癌治疗模式。源于M1巨噬细胞的EVs(M1 EVs)和双[2,4,5-三氯-6-(戊氧羰基)苯基]草酸酯(CPPO),二氢卟酚e6(Ce6)共同孵育后,用多柔比星原药aldoxorubicin(Dox-EMCH)进行电转化,以获得装载CPPO、Ce6和Dox-EMCH的EVs(M1CCD)。系统给药后,由于M1 EVs天然的靶向能力,制备的M1CCD在肿瘤中不断积累,而M1 EVs有效地将促肿瘤的M2巨噬细胞重新诱导为抗肿瘤的M1巨噬细胞,不仅表现出免疫治疗活性,而且产生H2O2。CPPO与增多的H2O2反应,产生的化学能在没有光激发的情况下直接激活光敏剂Ce6,产生用于成像的化学发光和用于PDT的单线态氧(1O2)。与此同时,由1O2引起的膜破裂导致前药Dox-EMCH释放,随后在酸性微环境中被迅速激活转化为毒性阿霉素(Dox),并渗透到肿瘤深部的低氧组织。免疫疗法,光动力疗法和化学疗法的协同作用产生了强大的抗癌效果和较小的副作用。这种智能工程化的EV递送系统作为癌症治疗候选方案非常有前景。
基本信息

题目:Self-Activatable Photo-Extracellular Vesicle for Synergistic Trimodal Anticancer Therapy
期刊:ADVANCED MATERIALS
影响因子:27.398
PMID:33432702
通讯作者:谢海燕
作者单位:北京理工大学
索莱宝合作产品:
产品名称 |
产品货号 |
Hydrogen Peroxide(H2O2) Assay Kit |
|
Hydrogen Peroxide(H2O2) Assay Kit |
|
Calcein-AM/PI活细胞/死细胞 双染试剂盒 |
摘 要
研究内容及结果
1. M1CCD具有自激活化学发光和1O2生成能力
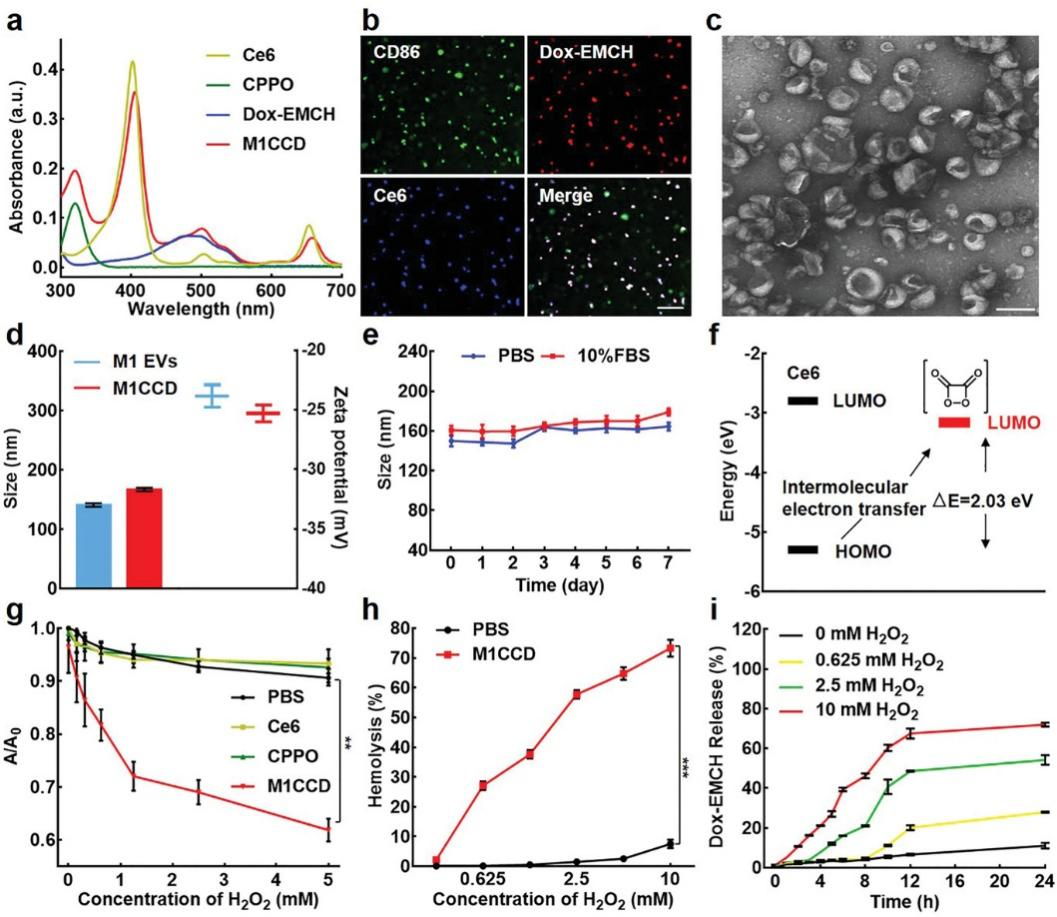
小鼠原始腹腔巨噬细胞首先用1ug/mL脂多糖(LPS)处理24小时极化形成M1巨噬细胞,通过流式细胞术确定极化效果。随后用经验证的超速离心程序纯化M1 EVs。EVs的磷脂双分子层通过疏水作用将CPPO和Ce6包裹起来,形成的亲水管腔装载水溶性的Dox-EMCH。为了装载尽可能多的药物,首先,作者分别研究了M1 EVs(约1010细胞颗粒mL-1)中CPPO、Ce6和Dox-EMCH的装载能力,发现装载饱和浓度分别为100、160和250 ug/mL。然后将相同数目的M1 EVs(约1010细胞颗粒mL-1)用100 ug/mL的CPPO和160 ug/mL的Ce6孵育,用250 ug/mL的Dox-EMCH进行电转化。通过CPPO、Ce6和Dox-EMCH紫外吸收光谱的特征吸收峰及其标志物的荧光成像效果验证这些药物是否成功装载(图2a,b)。每1×1010M1 EVs颗粒(n=6)CPPO、Ce6和Dox-EMCH的装载量分别为16.7±0.8,5.4±0.3,12.7±0.5ug。与原始M1 EVs相似,M1CCD的形态为典型的杯状(图2c),且装载药物后其Zeta电位几乎不变。M1CCD的水动力学尺寸为165±31nm(n=6),与原始M1 EVs相比增加了约36nm。M1CCD可在盐酸盐缓冲液(PBS)或10%胎牛血清中保存一周,显示出良好的稳定性(图2d,e)。
为实现化学激发的光动力疗法,有必要确定光敏剂的分子最高占据轨道(HOMO)与化学激发源的分子最低占据轨
北京索莱宝科技有限公司 商家主页
地 址: 北京市通州区中关村科技园区通州园金桥科技产业基地景盛南四街15号85A三层
联系人: 索莱宝-龚思雨
电 话: 010-50973130
传 真:
Email:3193328036@qq.com
相关咨询
携手同行,共赢未来|索莱宝20周年经销商大会暨品牌发布会圆满落幕! (2024-12-12T00:00 浏览数:1508)
喜报|热烈祝贺北京索莱宝科技有限公司荣获“北京市质量管理工作先进集体” (2024-12-12T00:00 浏览数:1471)
花香蝶自来|Solarbio小分子化合物“优秀员工展”第十五期 (2024-12-12T00:00 浏览数:1428)
自噬体标志物 (2024-12-12T00:00 浏览数:1012)
文献简报|一种用于增强癌症免疫治疗的极简型病原体样糖纳米疫苗 (2024-12-12T00:00 浏览数:1431)
官宣|索莱宝第五届病理杯美图创意大赛结果公布 (2024-12-09T00:00 浏览数:2600)
喜讯|热烈庆贺索莱宝荣获“科学技术协会”授牌 (2024-12-09T00:00 浏览数:3254)
FAQ|Solarbio 同位素标记物 (2024-12-09T00:00 浏览数:2561)
10月文献回顾索莱宝产品护航科研之旅 (2024-12-09T00:00 浏览数:3095)
白细胞介素之抗炎细胞因子 (2024-12-09T00:00 浏览数:2641)
